CFDA印发《医疗器械生产质量管理规范现场检查指导原则》
发布时间:2015-12-02 15:00:41
国家食品药品监督管理总局(CFDA)于2015年09月25日发布了《医疗器械生产质量管理规范现场检查指导原则》,其中包括了无菌医疗器械、植入医疗器械和体外诊断试剂医疗器械。该指导原则用于指导监管部门对医疗器械生产企业实施《医疗器械生产质量管理规范》及相关附录的现场检查和对检查结果的评估,适用于医疗器械注册现场核查、医疗器械生产许可(含延续或变更)现场检查,以及根据工作需要对医疗器械生产企业开展的各类监督检查。
新法规的要求比以前更加严格,我们医疗器械生产企业必须要认真学习和应对,按照法规要求,企业在现场检查的时候必须要以零发现,才能通过现场检查。具体要求如下:
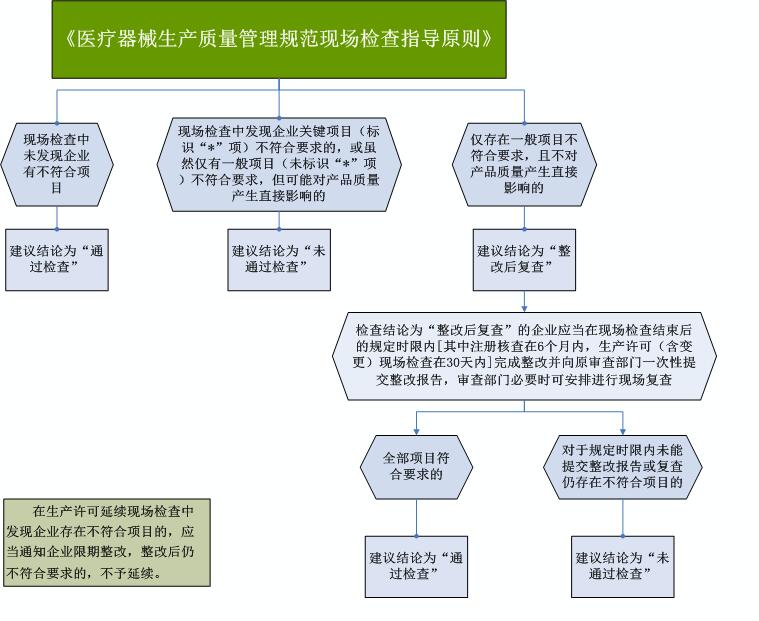
在医疗器械注册现场核查、生产许可(含变更)现场检查中,检查组应当依据指导原则对现场检查情况出具建议结论,建议结论分为“通过检查”“未通过检查”“整改后复查”三种情况。
另外,在各类监督检查中,发现关键项目不符合要求的,或虽然仅有一般项目不符合要求,但可能对产品质量产生直接影响的,应当要求企业停产整改;仅发现一般项目不符合要求,且不对产品质量产生直接影响的,应当要求企业限期整改;对于涉及违反《医疗器械监督管理条例》和相关法律法规的,应当依法依规进行处理。
随着《医疗器械生产质量管理规范》和相应检查指导原则的陆续出台,标志着医疗器械生产环节监管的法规制度体系在不断完善中,我们医疗器械生产企业必须要认真学习和应对,对新法规进行宣贯,组织相关部门对新法规的要求进行解读,以新法规的要求条款在公司内部进行预审核,发现存在的问题,及时进行整改,以符合新法规的要求。